| |
|
前言
隨著臨床上醫學影像檢查使用顯影劑 (contrast media) 的增加,顯影劑引起之腎病變(contrast-induced nephropathy, CIN) 成為臨床上重要的議題。事實上,CIN 是住院患者發生急性腎損傷的第三大常見原因,其毒性作用可能會導致住院天數增長,長期洗腎及死亡率的增加。CIN 的定義是指在沒有其他原因下,使用顯影劑後24~48 小時血清肌酸酐(serum creatinine) 比使用顯影劑前增加 0.5 mg/dL 或相對基準值提升25%。然而此定義對於原先血清肌酸酐基準量就已經偏高的患者而言是有疑慮的,因為血清肌酸酐些微的改變無法代表這類病人的腎絲球過濾率 (glomerular filtration) 有很大的變化。當發生CIN時,給予顯影劑後的 2~3 天內血清肌酸酐值會上升至最大值,大多數的患者在 14 天後可以恢復原有的腎功能,但並非所有病人的腎功能都能恢復[1]。在腎功能正常的病人,CIN 的發生率約< 2%,然而若患者原有腎功能不全或屬於糖尿病、充血性心衰竭、高齡或近期使用腎毒性藥物等發生CIN 的高危險群[2] (見表一),使用顯影劑後發生急性腎病變的機率則會提升至> 20-30% [3]。臨床上有各式各樣的方法被用於預防CIN 的發生,其中N-acetylcysteine (NAC) 是目前廣泛被研究且常被用來預防CIN 高危險群患者發生急性腎病變的藥物。過去十年來,許多學者研究NAC 用於預防CIN 的效果;然而各研究的異質性 (heterogeneity) 太高,所以其效益仍無定論[4]。
顯影劑分類
顯影劑可依離子性及滲透壓特性分為不同類型。傳統型顯影劑 (如diatrizoate)為離子性 (ionic) 或高滲透壓性(high-osmolality) ,這些顯影劑通常含有一個 (monomer, 單體) 或兩個 (dimmer, 雙聚體) 碘化苯環 (iodinated benzene ring)。離子性或高滲透壓性顯影劑相較於非離子性 (nonionic) 或低滲透性顯影劑易產生較多副作用,因此不再被廣泛用於心導管檢查 (catheterization laboratory)。目前常用的顯影劑為非離子性顯影劑,經化學結構修正,不會在溶液中解離出帶正、副電荷的離子且具有較低的滲透性,能降低對心臟血管系統的影響及減少副作用的發生。 非離子性顯影劑也可分為單體 (如iohexol,iopamidol) 與雙聚體 (iodixanol)[5]。
Aspelin P. 等人針對129 位糖尿病且腎功能不良的患者 (血清肌酸酐為1.5-3.5 mg/dL)使用顯影劑進行血管攝影對腎功能影響的研究,結果顯示,在注射顯影劑後0-3 天內平均血清肌酸酐上升的數值,等滲透壓非離子性顯影劑iodixanol 較低滲透壓非離子性顯影劑iohexol 來得低 (0.13 mg/dL vs. 0.55 mg/dL, p=0.001) 。此研究結果顯示,相較於低滲透非離子性顯影劑,對於CIN 高危險群患者,等滲透非離子性顯影劑似乎是較佳的選擇[6]。(本院顯影劑品項見表二)
CIN 致病機轉
目前CIN 的致病機轉仍不是很明確,現有已知的資料大多來自於動物實驗,歸納出兩個主要的致病機轉:腎血流動力學的改變所造成的缺血性損傷及顯影劑直接對腎小管所造成的細胞毒性。有研究顯示顯影劑使用後會造成vasopressin、angiotensin I、dopamine1、endothelin 及adenosine 的釋放,造成腎血管收縮活性的增加,或者使得血管舒張物質如一氧化氮 (nitric acid, NO)、prostaglandins 減少,使得腎血流減少,血氧供應較少,導致需氧量高的外側腎髓質(medulla)缺血缺氧[1,7]。高滲透性顯影劑亦會導致腎血管收縮造成腎血流及腎絲球過濾率(glomerular filtration rate, GFR) 的降低[1]。而顯影劑的黏稠度 (viscosity)越高及顯影劑導致紅血球的聚集,同樣也會造成腎血流及攜氧量的減少[8] 。至於顯影劑對腎小管細胞的直接毒性, 則是其會造成上皮細胞空泡化(vacuolization)、粒線體功能改變以及細胞凋亡[7]。研究發現顯影劑會使大鼠腎臟的抗氧化酶活性減少以及釋放氧自由基對大鼠造成直接性的腎臟細胞毒性[8]。
預防CIN 的方法
有循環衰竭 (circulatory collapse)或充血性心衰竭問題的病人,顯影劑應盡可能延後到血液動力學矯正後再給予。心肌梗塞者最快於梗塞發生後24 小時才可給予顯影劑。非CIN 高危險群之病人再次接觸顯影劑應與前次間隔48 小時,而糖尿病或腎功能不全的患者則需間隔72 小時。若已發生CIN,則應待病人血清肌酸酐濃度回到基準值才能再次給予顯影劑。NSAIDs、利尿劑及ACEIs 應該在顯影劑給予患者的前1-2 天前停止使用。更重要的是,對於CIN 高危險群患者,即使採用非離子性、低滲透性或等滲透性的顯影劑,也應使用最低劑量施打[8]。
顯影劑的腎毒性並無有效的治療方式,目前的研究著重於事先預防。使用顯影劑前中後補充水分(periprocedural hydration)、預防性投藥如N-acetylcystein 、fenoldopam、theophylline、ascorbic acid 等[1],或使用低滲透壓性顯影劑[6]皆有研究發現能降低CIN 的發生。液體的補充普遍被認為有預防的效果:給予等滲透壓之氯化鈉溶液和碳酸氫鈉溶液(154 mmol of sodium bicarbonate in 0.85 liters 5% dextrose)是兩種最常用的晶體溶液(crystalloid solution)[9]。然而在液體的選擇上,研究發現0.9%氯化鈉溶液較適合使用於低風險的患者,針對高風險的患者,碳酸氫鈉溶液的使用較能有效地減少CIN 的發生[1]。藥物預防方面,由於NAC 價格低廉,耐受性好,沒有顯著的副作用,被廣為用來預防CIN 的發生。
N-acetylcystein(NAC)作用機轉與臨床試驗研究結果
NAC 預防CIN 的作用機轉在於能夠清除氧自由基,減少氧自由基對腎小管的損害[10]。NAC 的代謝產物為cysteine,是glutathione 的前驅物質,會增加glutathione 的生合成,而glutathione 能夠清除氧自由基,在人體中扮演著防禦細胞遭受氧化損傷的核心角色[11]。此外,有研究發現NAC 可能與NO 結合產生更強更穩定的血管擴張物質Snitrosothiols,而有助於腎血流動力學的改善[12]。
Tepel M.等人在2002 年發表對NAC 預防CIN 的研究結果,83 名慢性腎功能不全的患者 (平均血清肌酸酐2.4 ± 1.3 mg/dL), 隨機分配至實驗組 ( 口服NAC 600 mg bid for 2 days 及靜脈注射0.45%氯化鈉溶液) 與對照組 (安慰劑及靜脈注射0.45%氯化鈉溶液),研究結果發現相較於對照組,實驗組CIN 的發生率明顯降低(2% vs. 21%, p=0.01) [10]。類似的結果可見於Diaz-Sandoval 等人所做的研究[13]。然而,後續的針對慢性腎功能不全患者的研究出現了不同的結果,也使得NAC 預防CIN 的效果產生爭議。 Briguori C.等人針對183 位腎功能不全的患者 (血清肌酸酐 > 1.2 mg/dL,肌酸酐清除率 < 70 mL/min)隨機分配至實驗組 ( 口服NAC 600 mg bid for 2 days 及靜脈注射0.45%氯化鈉溶液) 與對照組 (靜脈注射0.45%氯化鈉溶液),兩組CIN 發生率無顯著性差異 (6.5% vs. 11%,p=0.29) [14]。可能原因在於Briguori C.的試驗所使用的顯影劑平均劑量較Tepel M.所使用的劑量大 (197 mL vs. 75 mL),而顯影劑使用的劑量越大,所造成的腎毒性越大,因此理論上NAC 相對需要的劑量可能越多,才能達到保護的作用。Briguori C. 等人的研究中進一步分析給予較低劑量 (< 140 mL) 顯影劑之患者,發現對照組的腎功能明顯地惡化 (實驗組vs. 對照組CIN 的發生率:0% vs. 8.5%, p=0.02),至於給予較高劑量顯影劑的患者 (>140 mL) 則無顯著的差異 (實驗組vs.對照組CIN 的發生率:16% vs. 18.8%, p=0.78)[13]。Briguori C. 等人在2004 年更進一步研究,發現高劑量的NAC (口服1200 mg bid 使用2
天及靜脈注射0.45%氯化鈉溶液) 相較於對照組 (口服NAC 600 mg bid 使用2 天及靜脈注射0.45%氯化鈉溶液) 用於使用高劑量顯影劑的患者 (> 140 mL), 其CIN 的發生率明顯地降低 (5.4% vs. 18.9%, p=0.039), 但在使用低劑量(< 140 mL)顯影劑病人中則無顯著性差異 (實驗組vs. 對照組: 3.6% vs. 1.7%, p=0.61)[15]。
除了考慮試驗中所使用顯影劑的劑量不同,依據NAC 的藥物動力學特性評估這些試驗的結果,口服的NAC 其平均生體可用率約6-10%,且依口服劑型不同而異,而NAC 生體可用率的不同可能是造成試驗結果產生差異的原因之一。以NAC 口服劑型而言,歐洲 (如錠劑劑型) 及亞洲 (如固體顆粒劑型) 常用的口服劑型與北美洲 (如水劑) 不相同,而 NAC 化學結構上的sulfhydryl 基團可能與不同劑型中的添加物作用進而使得NAC生體可用率產生差異。NAC 劑型不同造成的生體可用率差異可能就是造成歐亞地區與北美的試驗結果不同的原因,在歐亞的試驗結果大都顯示NAC 可有效地降低CIN 的發生率,而北美洲的試驗結果則顯示無顯著預防效果[1,16]。此外,NAC 必須藉由口服後高度的首渡代謝 (first-pass metabolism)才能大量生合成具抗氧化作用的glutathione 之前驅物cysteine,因此,即使靜脈注射與口服NAC 有劑量生物等效性 (bioequivalence),其產生glutathione 的量卻會不相同,這也可能是靜脈注射NAC 預防CIN 的試驗結果不如預期的原因。另外,不同試驗所合併使用的輸液不具一致性、試驗中所收納的病人風險程度不同、缺乏試驗主要結果評估的一致性以及試驗中CIN 定義不同也可能是造成這些試驗結果具較大異質性的原因[1]。
結論
儘管NAC 預防CIN 的效果仍無定論,但由於NAC 價格便宜以及副作用較少的優點,且有不少研究對其持有正面的看法,臨床上仍普遍使用口服NAC 預防CIN。顯影劑使用前,建議先暫停所有腎毒性藥物的使用,對於CIN 高危險的住院病人,給予靜脈輸液補充並配合投予口服N-acetylcysteine,使用較低劑量的顯影劑及選擇低張或等張滲透壓的非離子性顯影劑以減少 CIN 的發生。目前較常使用於預防CIN 的NAC 使用方式為:口服NAC,每次600-1200 mg,於檢查前一天晚上,檢查當天早上(檢查前)、檢查當天晚上(檢查後),檢查後隔天早上,一共四個劑量;並且配合給予水分,住院病人可於檢查前靜脈給予0.9%氯化鈉溶液,一般使用1 mL/kg/hr (MAX 100 mL/hr) ,於注射顯影劑前後12 小時使用 (總共輸注24 小時)[17]。
表一、心導管(percutaneous coronary intervention)術後併發CIN 機率[2]
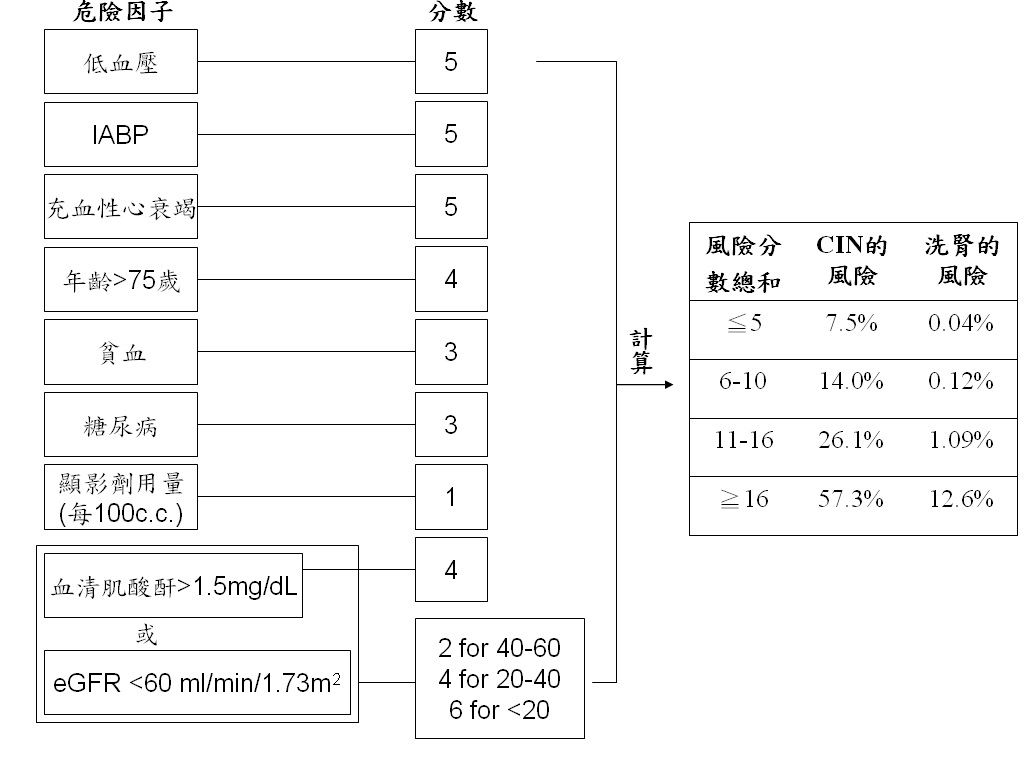
註1. 低血壓是指術後24 內SBP< 80 mmHg 大於1 小時,並需要inotropic support 或IABP (intra-aortic balloon pump)。
註2. 充血性心衰竭是指NYHA class III or IV 的心衰竭或有過肺水腫病史。
註3. 貧血是指男性血容比 < 39%,女性 < 36%。
表二、本院顯影劑品項(101/11/29)
| Ionic contrast media |
Non-inonic contrast media |
Ioxitalamate (Telebrix-35 100 mL)
high-osmolality |
Gadobutrol (Gadovist 1.0 15 mL)
high-osmolality |
| Gadoterate meglumine (Dotarem 20 mL) high-osmolality |
Iopromide (Ultravist 300 100 mL)
low-osmolality |
| Gadoterate dimeglumine (Multihance 20 mL) high-osmolality |
Iopromide (Ultravist 370 100 mL)
low-osmolality |
Gadoxetic acid (Primovist 10 mL)
low-osmolality |
Iohexol (Omnipaque 300 10 mL)
low-osmolality |
| |
Iohexol (Omnipaque 350 100 mL)
low-osmolalit |
參考文獻
1. Scott B and Edward F. Contrast-induced nephropathy. In: Pharmacotherapy Self- Assessment Program. 6th ed. American College of Clinical Pharmacy. P. 73-85.
2. Mehran R, Aymong ED, Nikolsky E, Lasic Z, Iakovou I, and Fahy M, et al. A simple risk score for prediction of contrast-induced nephropathy after percutaneous coronary intervention: development and initial validation. Am Coll Cardiol 2004; 44:1393-1399.
3. Morcos K, Thomsen S, and Webb A, et al. Contrast-media-induced nephrotoxicity: a consensus report. Contrast Media Safety Committee, European Society of Urogenital Radiology (ESUR). Eur Radiol. 1999; 9: 1602-1613.
4. Denise G, Kelly N, Steven K, Steve B, Pamela S, Robert S, Charles N, and Robert D, et al. A metaanalysis of N-acetylcysteine in contrast-induced nephrotoxicity: unsupervised clustering to resolve heterogeneity. BMC Med 2007, 5:32.
5. Sharma SK, Kini A. Effect of nonionic radiocontrast agents on the occurrence of contrast-induced nephropathy in patients with mild-moderate chronic renal insufficiency: pooled analysis of the randomized trials. Catheter Cardiovasc Interv 2005; 65: 386–393.6.
6. Aspelin P, Aubry P, Fransson SG, Strasser R, Willenbrock R, Berg KJ, et al. Nephrotoxic effects in high-risk patients undergoing angiography. N Engl J Med. 2003; 348:491-499.
7. Tepel M., Aspelin P., Lameire N, et al. Contrast-induced nephropathy: a clinical and evidence-based approach. Circulation. 2006;113(14): 1799-1806.
8. Ilan G and Shlomi M, Nephropathy induced by contrast media: pathogenesis, risk factors and preventive strategies. CMAJ. 2005 May 24; 172(11): 1461–1471.
9. Benko A, Fraser-Hill M, and Magner P, et al. Consensus guidelines for the prevention of contrast induced nephropathy. Canadian association of radiologists 2007; 58:79-87.
10. Tepel M, van der Giet M, Schwarzfeld C, Laufer U, Liermann D, and Zidek W, et al. Prevention of radiographic-contrast-agent-induced reductions in renal function by acetylcysteine. N Engl J Med. 2000 Jul 20; 343(3):180-184.
11. Fishbane S. N-Acetylcysteine in the Prevention of Contrast-Induced Nephropathy. Clin J Am Soc Nephrol 2008; 3: 281–287.
12. Drager F, Andrade L, Barros F, Laurindo R, MachadoA, and Seguro C, et al. Renal effects of Nacetylcysteine in patients at risk for contrast nephropathy: decrease in oxidant stress-mediated renal tubular injury. Nephrol Dial Transplant. 2004 Jul; 19(7):1803-1807.
13. Diaz-Sandoval LJ, Kosowsky BD, and Losordo DW, et al. Acetylcysteine to prevent angiographyrelated renal tissue injury (the APART Trial). Am J Cardiol 2002; 89: 356-358
14. Briguori C, Manganelli F, and Scarpato P et al. Acetylcysteine and contrast agent-associated nephrotoxicity. J Am Coll Cardiol 2002; 40: 298-303.
15. Briguori C, Antonio C, Violante A, Balestrieri P, Manganelli F, Elia PP, Golia B, Riviezzo G, Lepore S, Scarpato P, Focaccio A, Librera M, Bonizzoni E, and Ricciardelli B, et al. Standard vs double dose of N-acetylcysteine to prevent contrast agent associated nephrotoxicity. Eur Heart J 2004 25 (3): 206-211.
16. Gonzales A, Norsworthy J, and Kern J, et al. A meta-analysis of N-acetylcysteine in contrastinduced nephrotoxicity: unsupervised clustering to resolve heterogeneity, BMC Med 2007, 5:32.
17. Steven D, Guidelines for Contrast-Induced Nephropathy+CIN) Prevention in Adults. University of Kentucky Chandler Medical Center. 2009
|